美國FDA發布菸草產品上市前兩項原則
據《台灣威卜 菸草減害網路媒體 VAPE Taiwan》報導,根據美國食品與藥品管理局發布的一份新聞稿,該局已經為那些尋求希望能夠上市銷售菸草新產品的公司製定了兩項關鍵的原則。
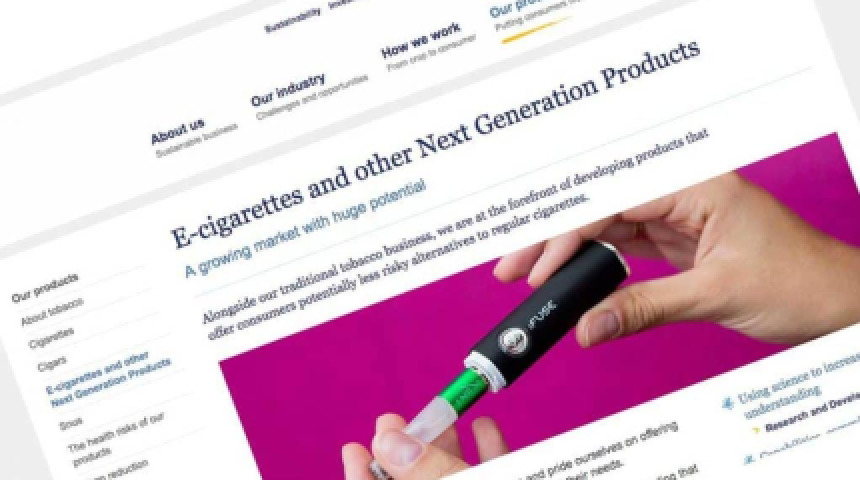
照片

據介紹,兩項原則都包含了關於菸草商上市前菸草製品申請(Premarket Tobacco Product Applications, PMTA)以及實質性等效原則(Substantial Equivalence, SE)所報告的內容、格式以及審查的最低要求等相關事宜。 PMTA和SE是製造商們需要向FDA申請菸草新品上市許可時可以選擇的兩種途徑。
根據PMTA,通常電子菸鹼傳送系統(即END)的製造商,必須向主管機關證明所申請的新的菸草製品銷售對保護公眾健康是適當的。
根據SE,通常適用於申請普通香菸產品、無煙菸草製品、雪茄煙產品、水菸產品等,這就意味著美國食品與藥品管理局必須確定菸草商們所申請的新產品與原來的菸草製品有不同的特性,但同時也不會加大公共衛生健康問題。
《吸煙有害健康》
《衛生福利部國民健康署戒煙專線0800-636363》
延伸閱讀:
監察院調查報告 – 美國輝瑞基金會、台灣輝瑞藥廠、財團法人董氏基金會



回應文章建議規則: